MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien:

MLZ
Lichtenbergstr.1
85748 Garching
18.04.2024
Effiziente Eisenfänger
Das Cyanobakterium Prochlorococcus ist das kleinste und am häufigsten vorkommende Lebewesen der Welt, das Photosynthese betreibt. Es hat einen besonders effizienten Weg gefunden, lebenswichtiges Eisen aufzunehmen und zu speichern. Mithilfe von Neutronen-, Röntgen- und Synchrotronexperimenten hat ein internationales Forscherteam nun erstmals den molekularen Mechanismus sichtbar gemacht.
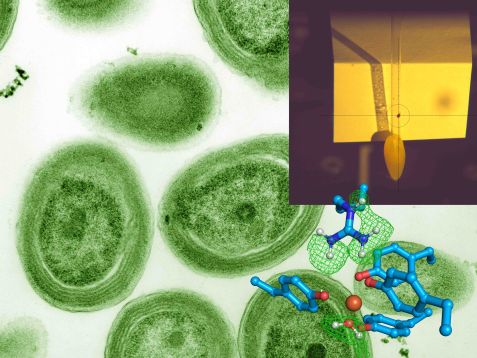
Das Forscherteam hat das Bakterium Prochlorococcus analysiert (Hintergrund). Im Fadenkreuz des Instruments Biodiff (oben rechts) ist einer der Kristalle des FutA Proteins, der zu der unten abgebildeten Struktur führte. Eisen (rostrot) ist in der Mitte dargestellt. Die blauen Aminosäureseitenketten und ein Wassermolekül (unten rechts) binden an das Eisen. Das Neutronenexperiment zeigte, wo sich die Wasserstoffatome befinden, die durch ein Gittergeflecht aus grünen Linien eingehüllt dargestellt sind. © Dr. Tobias Schrader, Forschungszentrum Jülich; Luke Thompson from Chisholm Lab and Nikki Watson from Whitehead, MIT, CC0, via Wikimedia Commons (Hintergrundbild)
Das Meer ist das größte Ökosystem der Erde. Darin lebende Organismen, die Photosynthese betreiben, produzieren etwa die Hälfte des Sauerstoffs auf der Erde. Gleichzeitig sind sie eine wichtige Kohlenstoffsenke im Kampf gegen den Klimawandel. Jedes Jahr binden sie insgesamt 45 Giga-Tonnen Kohlenstoff. Photosynthetische Bakterien sind dabei einer der Hauptakteure, das Cyanobakterium Prochlorococcus hält mehrere Rekorde auf diesem Gebiet: Mit einem halben Mikrometer Durchmesser – das entspricht einem halben Millionstel Meter – ist es der kleinste photosynthetische Organismus der Erde. Es produziert vier Gigatonnen gebundenen Kohlenstoff pro Jahr, was der jährlichen Nettoprimärproduktion der weltweiten Landwirtschaft entspricht. Seine photosynthetische Aktivität hängt jedoch von Eisen ab, und das ist im Ozean nur begrenzt vorhanden.
Ein Protein bindet zwei Eisenformen
Biologisch relevantes Eisen kann in der Natur in zwei verschiedenen Oxidationsstufen vorkommen, als zwei- oder dreiwertige Eisen-Ionen, Fe 2+ und Fe 3+ – also als geladenes Atom, das zwei oder drei Elektronen abgegeben hat. Die meisten Organismen und auch Cyanobakterien besitzen in der Regel zwei verschiedene Proteine, um diese verschiedenen Oxidationsstufen aufzunehmen. Nicht so Prochlorococcus, das beide Formen des Eisens durch ein einziges Protein binden kann.
Stark reduziertes Erbgut im winzigen Bakterium
Die Forscher vermuten, dass diese Doppelfunktion ein wichtiger Grund für den ökologischen Erfolg ist und mit dem kompakten Genom von Prochlorococcus zusammenhängt. Da dieses Meeresbakterium so winzig ist, verfügt es nur über ein stark reduziertes Erbgut und muss daher mit einer begrenzten Anzahl von Genen auskommen, die in unterschiedliche Proteine übersetzt werden könnten.

Dr. Tobias Schrader, Instrumentwissenschaftler des BioDiff, am Heinz Maier-Leibnitz Zentrum. © Bernhard Ludewig, FRM II / TUM
Molekularer Schalter entdeckt
Eine internationale Forschergruppe um Prof. Dr. Ivo Tews von der Universität Southampton konnte nun erstmals den Mechanismus aufzeigen, über den Prochlorococcus die beiden verschiedenen Formen von Eisen aufnimmt. Dabei entdeckten sie einen molekularen Schalter, der es dem Bakterium ermöglicht, zwischen der Bindung von zwei- und dreiwertigen Eisen-Ionen hin und her zu schalten. Das sogenannte FutA-Protein erfüllt zudem noch eine weitere Funktion. Es ist im Bakterium nicht nur für die Aufnahme, sondern auch für den Schutz des bereits aufgenommenen Eisens zuständig.
Kombination von Röntgen, Neutronen und Spektroskopie
Die Entdeckung wurde möglich durch eine neuartige Kombination von Experimenten. Die Forscher haben Röntgenstrahlen, Neutronenstrahlen und Lichtabsorption eingesetzt, um die Eisenbindung zu verstehen. Zudem nutzten sie Röntgenstrahlung, um zwischen den beiden Formen des Eisens wechseln zu können. In mehreren Experimenten, die an der Diamond Light Source und auch am RIKEN SPring-8 Center in Japan durchgeführt wurden, haben die Forscher die Position der Atome bestimmt – mit Ausnahme der Wasserstoffatome. Deren Anordnung ließ sich erst mithilfe von Neutronenstrahl-Experimenten sichtbar machen.
Neutronen zeigen Ladungszustand des Eisens
Experimente mit Neutronenstrahlen an der Forschungs-Neutronenquelle Heinz Maier-Leibnitz (FRM II) in Garching halfen so, den Ladungszustand des Eisens zu verstehen. „Das Diffraktometer BIODIFF, das wir hier vom Forschungszentrum Jülich aus gemeinsam mit der Technischen Universität München betreiben, ist darauf spezialisiert, die Position der Wasserstoffatome in solchen großen Molekülen zu ermitteln“, erklärt Dr. Tobias Schrader vom Jülich Centre for Neutron Science (JCNS) und Instrumentwissenschaftler am BioDiff. Aus den Ergebnissen berechneten die Forschenden die Ladungen der Aminosäure-Seitenketten im Protein, die sich um das Eisen herum befinden. Diese lassen dann wiederum Rückschlüsse auf die die Ladung des Eisens zu.
“Einen Kernreaktor zu benutzen, um die Wasserstoffatome zu sehen, war für mich wirklich spannend. Sogar die Wasserstoffatome im Wasser waren deutlich sichtbar”, berichtet Rachel Bolton, Doktorandin an der Universität Southampton, die die Experimente in Garching durchgeführt hat.
Originaltext:
University of Southampton / Forschungszentrum Jülich
Originalpublikation:
Rachel Bolton, Moritz M. Machelett Jack Stubbs, Danny Axford, Nicolas Caramello, Lucrezia Catapano, Martin Malý, Matthew J. Rodrigues, Charlotte Cordery, Graham J. Tizzard, Fraser MacMillan, Sylvain Engilberge, David von Stetten, Takehiko Tosha, Hiroshi Sugimoto, Jonathan A. R. Worrall, Jeremy S. Webb, Mike Zubkov, Simon Coles, Eric Mathieu, Roberto A. Steiner, Garib Murshudov, Tobias E. Schrader, Allen M. Orville, Antoine Royant, Gwyndaf Evans, Michael A. Hough, Robin L. Owen, and Ivo Tews
A redox switch allows binding of Fe(II) and Fe(III) ions in the cyanobacterial iron-binding protein FutA from Prochlorococcus
PNAS 121 (12) e2308478121 (2024)
DOI: 10.1073/pnas.2308478121
MLZ ist eine Kooperation aus:
 > Technische Universität München
> Technische Universität München > Helmholtz-Zentrum Hereon
> Helmholtz-Zentrum Hereon
 > Forschungszentrum Jülich
> Forschungszentrum Jülich
MLZ ist Mitglied in:
 > LENS
> LENS > ERF-AISBL
> ERF-AISBL
MLZ in den sozialen Medien:



